L'expérience du « bouillant de Franklin » permet de vérifier l'influence de la pression sur la température l'ébullition d'un liquide(1). (©Maël Dancette)
Spontanément, de nombreuses personnes pensent que l’eau « pure » bout à 100°C (ou 212°F) en toute circonstance. Pourtant, cette donnée se vérifie uniquement sous une condition particulière de pression, en l’occurrence sous pression d’1 atmosphère, soit une valeur proche de 1 bar(2).
Couple pression/température
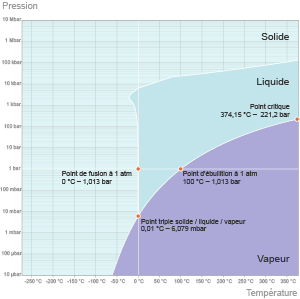
L’eau, comme tous les corps purs, est liquide, gazeuse ou solide selon les conditions de température T mais aussi de pression p auxquelles elle est soumise. Ce couple pression-température détermine les changements d’état de l’eau qui peuvent être calculés grâce à la formule de Clapeyron (du nom du physicien Émile Clapeyron qui l'a établie en 1834, formule illustrée par le graphique ci-dessous).
Une baisse de pression réduit la température d’ébullition de l’eau, depuis son point critique (T = 374°C, p = 220 bars) au-delà duquel liquide et gaz sont indissociables jusqu’à son point triple (T = 0,01°C, p ≈ 6 millibars) au-dessous duquel subsistent seules les phases solides et gazeuses. Entre ces deux points, on passe par l’ébullition classique à 100°C sous un bar de pression. (©2012)
Une baisse de pression réduit la température d’ébullition de l’eau, une hausse de pression l’augmente. Par exemple, en haut du mont Blanc (à une altitude de 4 806 m) où la pression (p = 0,5 bar) diminue de moitié par rapport à la pression atmosphérique, l’eau bout à 85°C. En haut de l’Everest (à une altitude de 8 849 m), l'eau bout à près de 72°C.
Pourquoi le point d'ébullition de l'eau salée est-il plus élevé ?
L'eau de mer ou l'eau qu'on sale en cuisine bout à une température légèrement plus élevée que l'eau « pure » : les ions du sel dissous se lient aux molécules d’eau, ce qui retarde leur passage à l’état gazeux.
La température doit être supérieure à 100 °C pour casser ces liaisons et faire bouillir l'eau (il est par exemple estimé que le point d'ébullition est augmenté de 0,5°C pour de l'eau contenant près de 30 g de sel par litre d'eau(3)).
Réacteur nucléaire à eau pressurisée
L’eau de refroidissement d’un réacteur nucléaire à eau pressurisée (PWR), qui fonctionne autour de 300°C, doit être mise sous une pression de 155 bars pour la tenir loin de l’ébullition. En créant une forte dépression (jusqu’à près de 25 millibars), il est même possible de faire bouillir de l’eau à température ambiante.
Notons que, soumise à une pression de 6 millibars et à une température de 0,01°C, l’eau se trouve simultanément sous trois états différents : solide, liquide et gazeux. Ces conditions particulières correspondent au « point triple de l’eau ».